定期報告とは
研究責任医師(多施設共同研究の場合は、研究代表医師)は、定期的(原則として実施計画を厚生労働大臣に提出した日から起算して一年ごとに当該期間満了日より二月以内)に認定臨床研究審査委員会に定期報告を提出する必要があります。
なお、定期報告には以下の記載が必要です。
一 当該特定臨床研究に参加した特定臨床研究の対象者の数
二 当該特定臨床研究に係る疾病等の発生状況及びその後の経過
三 当該特定臨床研究に係るこの省令又は研究計画書に対する不適合の発生状況及びその後の対応
四 当該特定臨床研究の安全性及び科学的妥当性についての評価
五 当該特定臨床研究に対する第二十一条第一項(*利益相反管理基準)各号に規定する関与に関する事項
定期報告の手続き
(1)定期報告の審査
- 定期報告の審査を希望する場合は、倫理審査申請システムから申請を行ってください。
東北大学 認定臨床研究審査委員会申請システム(臨床研究法対応版)
委員会の開催日及び〆切については「委員会日程」 のページをご確認ください。
- ご不明な点は、お問い合わせフォーム よりお問い合わせください。
(2)定期報告のフロー
定期報告の際の手順は以下をご参照ください。 【フロー図】
STEP1:医療機関の管理者への報告、委員会への申請
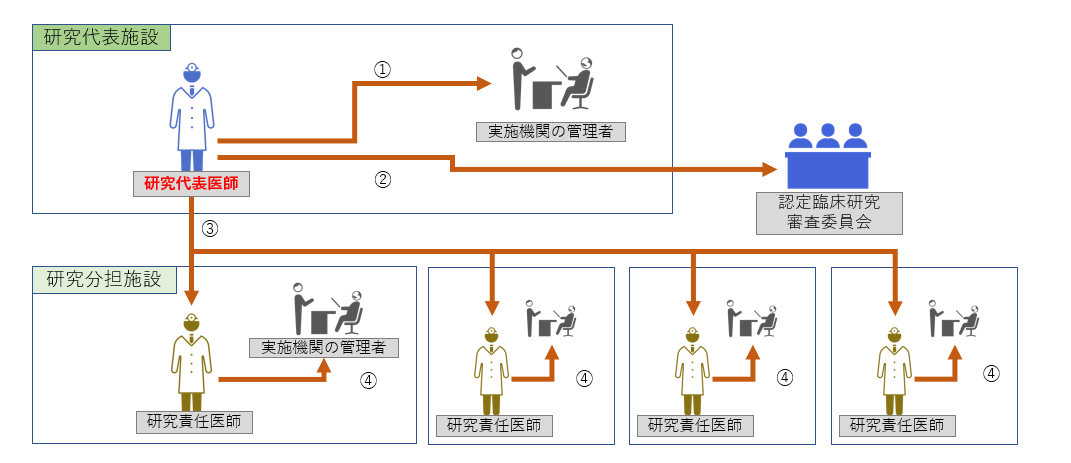
|
① 【研究代表医師】 ② 認定臨床研究審査委員会への申請
③ 全研究責任医師への情報共有 ④ 【研究責任医師】 |
STEP2:委員会審査、厚生労働大臣と研究機関の長への報告
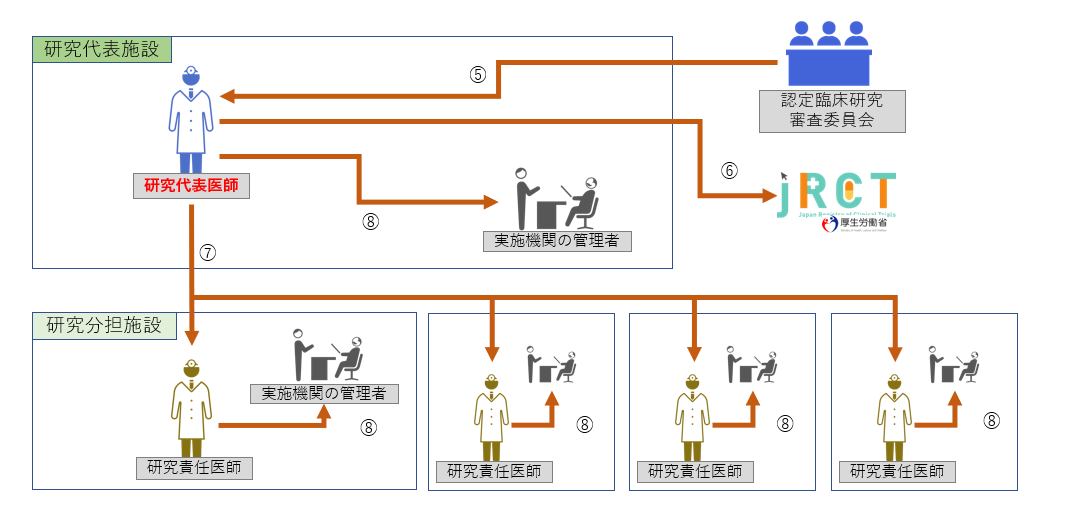
|
⑤ CRBでの審査、審査結果の受領 ⑥ jRCTへの届出 ⑦ 全研究責任医師への情報共有 ⑧ 実施医療機関の長への報告 |
(3)提出書類
定期報告の審査時の提出書類は以下のとおりです。
| No. | 書式名 | 備考 |
|---|---|---|
| ① | 定期報告書(統一書式5) (各種書式) | |
| - | 利益相反管理基準(様式A)、利益相反管理計画(様式E) | 変更した場合のみ |
| 【参考】利益相反管理について | ||
なお、厚生労働大臣への報告(jRCTへの届出)は、認定臨床研究審査委員会の審査後「別紙様式3 定期報告書」により行う必要があります。
(4)審査手数料
審査には以下の審査手数料(税込)が必要です。申請者(研究代表医師)が東北大学に所属している場合と、学外の場合では審査手数料が異なります。
| 区分 | 定期報告 |
|---|---|
| 東北大学内の申請 | 50,000円 |
| 学外からの申請 | 150,000円 |
・お支払いいただいた審査費用は、原則として返還いたしません。
・審査結果にかかわらず、上記費用をお支払いいただきます。
・複数年分をまとめてのお支払いも受け付けております。ご希望される場合は、事務局までご連絡ください。
審査結果通知後の手続き
(1)jRCTへの届出
研究責任医師(多施設共同研究の場合は、研究代表医師)は、認定臨床研究審査委員会の結果が通知されてから、1月以内にjRCTの届出を行う必要があります。
届出は、jRCTから作成する「別紙様式3 定期報告書」にて行います。
(2)実施医療機関の管理者への報告
jRCTへの届出と併せて、医療機関の管理者への報告を行う必要があります。
報告の手続きについては、各医療機関ごとで異なります。
東北大学病院における報告手続き
- 「東北大学病院-倫理委員会ポータル」をご覧ください。
東北大学病院以外の施設の報告手続き
- 各医療機関の担当者にご確認下さい。
