不適合報告とは
研究責任医師は、省令⼜は研究計画書に適合していない状態(以下「不適合」という。)であると知ったときは、速やかに、実施医療機関の管理者に報告する必要があります。
また、特に重⼤なものが判明した場合においては、速やかに認定臨床研究審査委員会の意⾒を聴かなければなりません。
重大な不適合報告の記載内容は以下となります。
一 不適合の内容(資料名(添付する場合)を併記)
二 不適合が発生した理由、再発防止策等
重大な不適合報告の手続き
(1)重大な不適合報告の審査
- 重大な不適合報告の審査を希望する場合は、倫理審査申請システムから申請を行ってください。
東北大学 認定臨床研究審査委員会申請システム(臨床研究法対応版)
委員会の開催日及び〆切については「委員会日程」 のページをご確認ください。
- ご不明な点は、お問い合わせフォーム よりお問い合わせください。
(2)重大な不適合報告のフロー
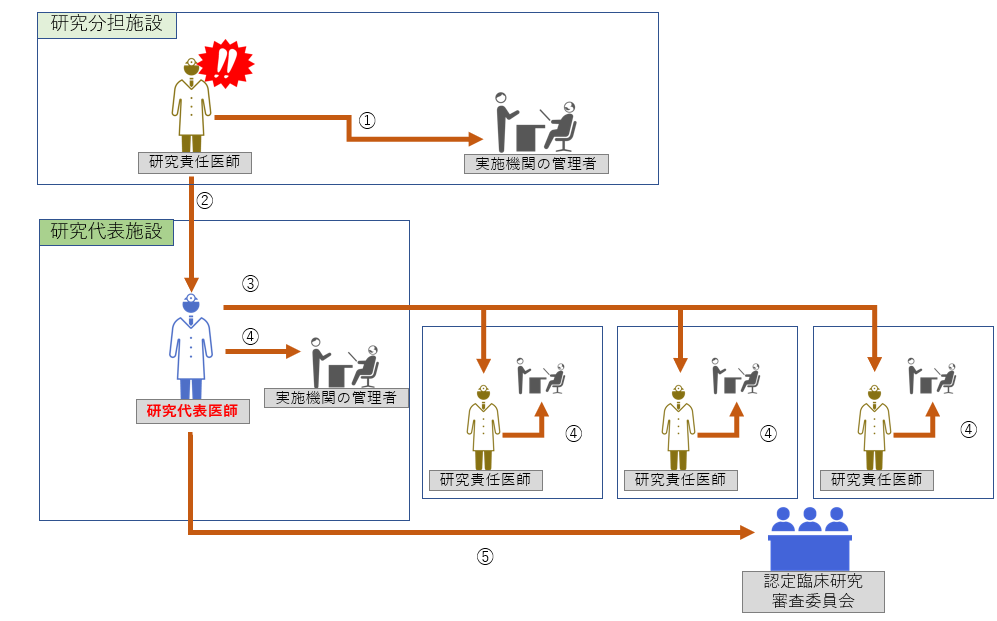
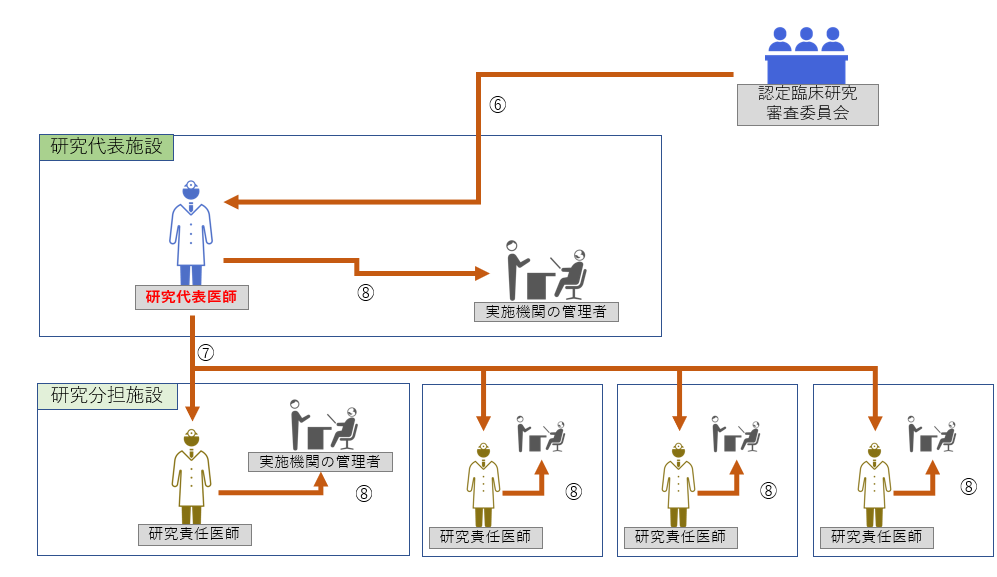
重大な不適合の際の手順は以下をご参照ください。 【フロー図】
Step1:認定臨床研究審査委員会の審査まで
|
① ≪発生機関≫ ② 研究代表医師への情報共有 ③ 他の研究責任医師への情報共有 ④ ≪非発生機関≫ ⑤ 認定臨床研究審査委員会への報告 |
Step2:認定臨床研究審査委員会の審査後
|
⑥ 審査結果の受領 ⑦ 他の研究責任医師への情報共有 ⑧ ≪全機関≫ 実施医療機関の長への報告 |
(3)提出書類
重大な不適合の審査の提出書類は以下のとおりです。
| No. | 書式名 | 備考 |
|---|---|---|
| ① | 重大な不適合報告書(統一書式7) (各種書式) |
