【認定臨床研究審査委員会での審査】
(1)認定臨床研究審査委員会審査とは
(2)臨床研究開始のフロー
【新規審査依頼の手続き】
(1)審査依頼の前に
(2)提出書類
(3)審査手数料
(4)審査までの流れ
【審査結果『承認』の場合の手続き】
(1)『承認』の審査結果通知
(2)実施医療機関の管理者の許可
(3)jRCTへの届出
(4)研究開始の報告
【審査結果『承認』以外の場合の手続き】
(1)『継続審査』の審査結果通知
(2)『不承認』の審査結果通知
認定臨床研究審査委員会での審査
(1)認定臨床研究審査委員会審査とは
臨床研究法に基づいて臨床研究を実施するためには、厚生労働大臣が認定した認定臨床研究審査委員会での審査が必要となります。
ご自身の研究が、本委員会での審査の対象か否かは下記チェックリスト、及び「臨床研究法の対象となる臨床研究」をご確認ください。
・特定臨床研究の該当性に関するチェックリスト (※厚生労働省のページに移動します)
なお、「人を対象とする医学系研究に関する倫理指針」に基づいて実施する研究の審査の手続きについては、「東北大学病院-倫理委員会ポータル」をご覧ください。
(2)臨床研究開始のフロー
新たに臨床研究を開始する際の手順は以下をご参照ください。 【フロー図】
STEP1:認定臨床研究審査委員会の審査
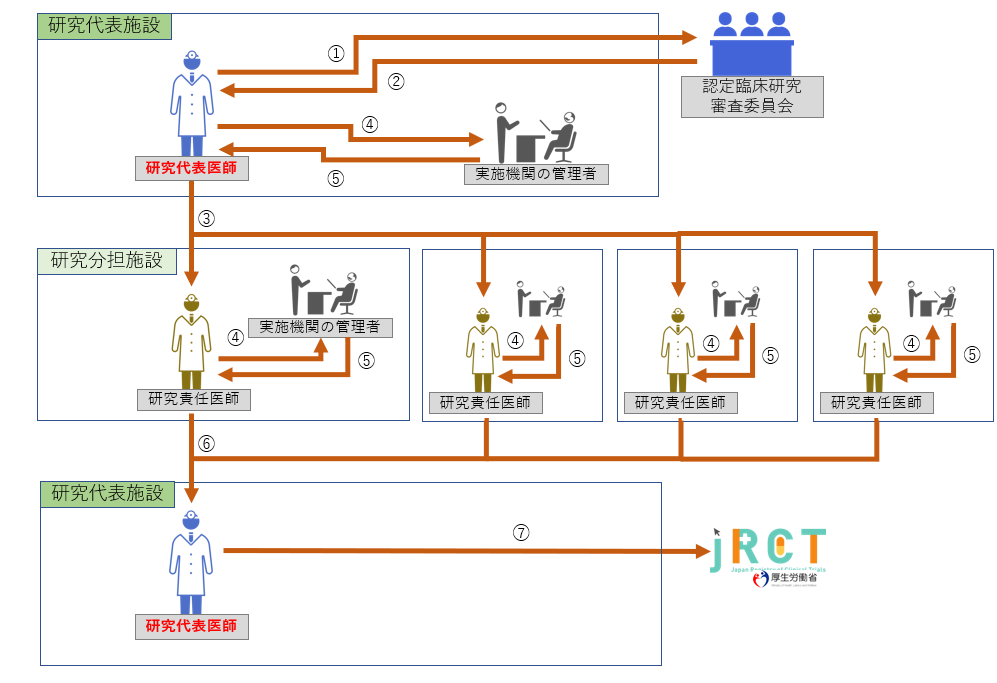
|
① 認定臨床研究審査委員会の審査 ② 審査結果の受領 ③ 全ての研究責任医師への情報共有 ③ 実施機関の管理者の実施許可申請 ⑤ 実施機関の管理者の許可 ⑥ とりまとめ ⑦ jRCT(厚生労働大臣)への届出 |
STEP2:研究機関の長への報告
⑧ 届出が完了したことを各実施医療機関の長に報告
届け出た研究が、jRCTに公開されるまでは、研究を開始出来ません。
新規審査依頼の手続き
(1)審査依頼の前に
-
臨床研究の新規審査を希望する場合は、研究代表医師のチェックリスト を確認し、審査依頼の準備ができていることを確認ください。
【参考】
・特定臨床研究の該当性に関するチェックリスト (※厚生労働省のページに移動します)
・(学外の申請者の場合)契約書
- 委員会への審査依頼を希望する場合は、「東北大学CRB 倫理審査申請システム(臨床研究法対応版)」から申請を行ってください。
- 学内・学外問わず審査依頼を受け付けておりますが、申請者(研究代表医師)が東北大学に所属している場合と、学外の場合では委員会申請前の手続きが異なります。
学内研究者からの申請
- 東北大学病院臨床研究推進センター(CRIETO)では、研究計画の作成支援、相談、統計コンサルテーション等を受け付けております。ご希望される場合は、お問合せ学内専用ページをご確認ください。(学内LAN、、seiryo-user、VPNのいずれかで接続してください。)
- 上記の支援を受けない場合であっても、本委員会の申請前に、臨床研究推進センターパートナー部門による事前相談を受ける必要があります。(パートナー部門への相談も、お問合せ学内専用ページをご覧ください。)東北臨床研究審査委員会への申請の際に、パートナー部門より発行された「事前相談実施確認書」を添付する必要がありますので、申請を予定されている場合は、期間に余裕をもって相談をお申し込みください。
- 相談後は「東北大学CRB 倫理審査申請システム(臨床研究法対応版)」に入り、「■ 臨床研究審査委員会に申請する場合はこちらから:新規審査申請」より、委員会への審査依頼を行ってください。
- はじめてログインされる方は、倫理審査申請システムからユーザー申請を行ってください。
- 「東北大学 認定臨床研究審査委員会申請システム(臨床研究法対応版)」より、「新規審査申請」から進み、資料((2)提出書類参照)を登録ください。
学外研究者からの申請
(2)提出書類
提出書類については、事前に自己チェックシート(委員会様式) にてご確認ください。
新規審査の提出書類は、以下の「 提出書類 一覧」をクリックしてご確認ください。
| No. | 書式名 | 備考 |
|---|---|---|
| ⓪ | 自己チェックシート(委員会様式) | |
| ① | 新規審査申請書(統一書式2) (各種書式) | |
| ② | 実施計画(省令様式1) | jRCTより作成すること |
| 【参考】(※厚生労働省のページに移動します。) 実施計画の提出方法、実施計画書き方モデル、jRCT入力モデル |
||
| ③ | 研究計画書 | |
| 【参考】東北大学病院テンプレート ※必ずしも同テンプレートにて作成する必要はございません。 |
||
| ④ | 説明文書・同意文書 | |
| 【参考】東北大学病院テンプレート ※必ずしも同テンプレートにて作成する必要はございません。 |
||
| ⑤ |
被験者の補償について説明した文書 |
|
| 【参考】東北大学病院テンプレート ※必ずしも同テンプレートにて作成する必要はございません。 |
||
| ⑥ | 医薬品等の概要を記載した書類(試験薬概要書・添付文書 等) | |
| ⑦ | 疾病等が発生した場合の対応に関する手順書 ※作成した場合 | |
| ⑧ | モニタリングに関する手順書 | |
| ⑨ | 監査に関する手順書 ※作成した場合 | |
| ⑩ | 利益相反管理基準(様式A)、利益相反管理計画(様式E) | ※様式A、EのみをPDFにして提出 ※事前の実施施設での確認が必要 |
| 【参考】 利益相反管理について | ||
| ⑪ | 研究分担医師リスト(統一書式1) (各種書式) | |
| ⑫ | 統計解析計画書 ※作成した場合 | |
| ⑬ | 実施医療機関の要件(統一書式 参考書式2) (各種書式) | |
| ⑭ | 教育記録申請書(委員会様式) (各種書式) | |
| ⑮ | その他の資料 ※作成した場合 ・被験者の募集の手順(広告等)に関する資料 ・被験者の安全等に係る資料 等 |
|
(3)審査手数料
審査には以下の審査手数料(税込)が必要です。申請者(研究代表医師)が東北大学に所属している場合と、学外の場合では審査手数料が異なります。
| 区分 | 新規申請 | 定期報告 |
|---|---|---|
| 東北大学内の申請 | 100,000円 | 50,000円 |
| 学外からの申請 | 300,000円 | 150,000円 |
・お支払いいただいた審査費用は、原則として返還いたしません。
・審査結果にかかわらず、上記費用をお支払いいただきます。
・複数年分をまとめてのお支払いも受け付けております。ご希望される場合は、事務局までご連絡ください。
・定期報告については、「定期報告の手続き」をごらんください。
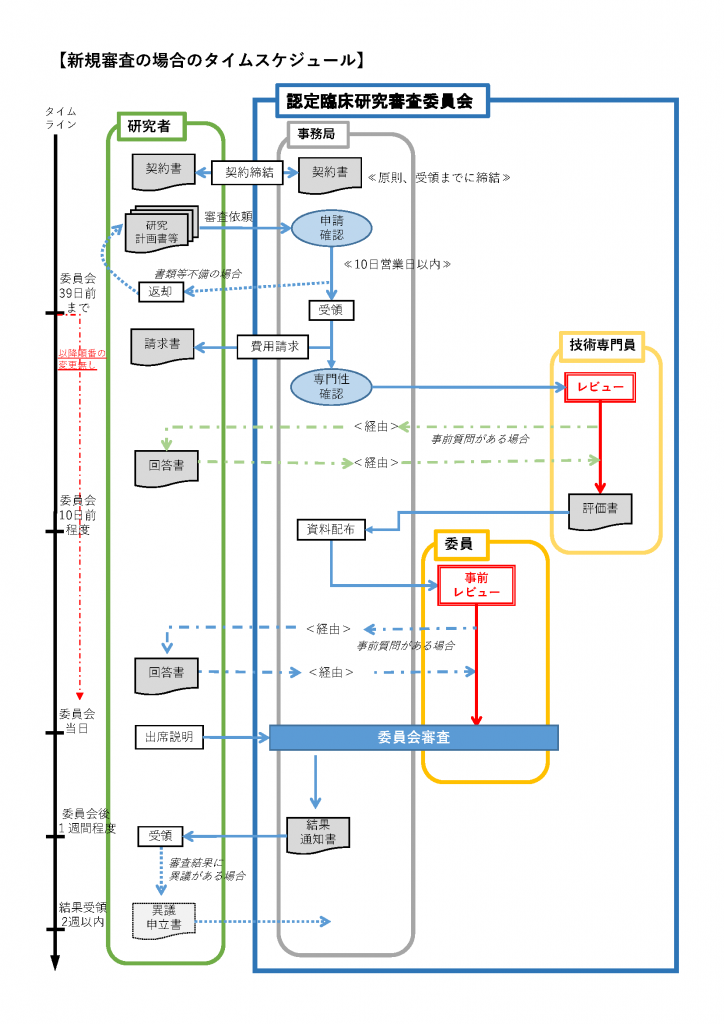
(4)審査までの流れ
- 審査依頼
・委員会の開催日及び〆切については「委員会日程」 のページをご確認ください。
・提出いただいた書類は、委員会事務局により審査資料としての充足性(記載不備や書類の不足)の確認を致します。なお、事務局による充足性の確認には10営業日~5営業日を要します。
・〆切は提出日基準ではなく、事務局が書類の充足性を確認した日が基準となります。書類が充足していない場合は、期限までにご提出いただいても希望する委員会での審査が行うことはできません。期限に余裕をもって書類をご提出ください。
・書類の提出前に、必ず自己チェックシート(委員会様式) にて、ご自身による充足性の確認を行ってください。 - 審査手数料の請求
・委員会事務局より審査手数料のご連絡を差し上げます。指定された期日までのお支払いをお願いします。 - 委員会前の確認
・申請の受付後は、技術専門員、委員による審査書類の確認が行われます。技術専門員、委員から、申請された研究について疑義照会が(複数回)行われる場合があります。 - 委員会審査
・委員の合議により、研究の実施の適否等の審査を行います。新規審査依頼の場合、委員会の場において研究概要等についてのご説明をお願いしております。 - 審査結果通知
・委員会審査より1週間程度を目安に審査結果通知書を発行します。
【イメージ図】 (PDF)
審査結果『承認』の場合の手続き
(1)『承認』の審査結果
「申請された研究を実施することが適切である」と委員会が判断した場合は、『承認』の審査結果が発行されます。審査結果が『承認』だった場合、実施医療機関の管理者の許可申請をし、jRCTへの届出を行ってください。
なお、委員会から要望事項が付記された場合は、変更の必要性を検討の上、jRCTの届出後に変更手続きを行ってください。
(2)実施医療機関の管理者の許可
認定臨床研究審査委員会後は、医療機関において研究を実施することについての許可を得る必要があります。
実施許可手続きについては、各医療機関ごとで異なります。
東北大学病院における許可手続き
- 2019年11月以降に新たに開始する研究については、引き続き「東北大学CRB 倫理審査申請システム(臨床研究法対応版)」より実施許可申請を行って下さい。
- 具体的な許可手続きについては、「東北大学病院-倫理委員会ポータル」をご覧ください。
東北大学病院以外の施設の許可手続き
- 各医療機関の担当者にご確認下さい。
(3)jRCTへの届出
実施医療機関の許可を得たら、jRCTに届出を行います。具体的な手続きについては「jRCT」の操作マニュアルをご確認下さい。
なお、多施設共同研究を実施する場合において、実施医療機関の許可のタイミングが揃わない時は、実施医療機関の許可を得た施設からjRCTへの届出を行うこともできます。
(4)研究開始の報告
jRCTに研究が掲載されたら、いよいよ研究の開始が可能となります。
jRCTに掲載され、研究が開始できる状態となったことを、発行された臨床研究実施計画番号とともに「認定臨床研究審査委員会」と「実施医療機関の管理者」に報告をしてください。
審査結果『承認』以外の場合の手続き
(1)『継続審査』の審査結果通知
「申請された研究を実施することが適切では無く、変更や記載の明確化が必要である」と委員会が判断した場合は、『継続審査』の審査結果が発行されます。審査結果が『継続審査』だった場合は、再度委員会の審査が必要です。
委員会の指摘に基づき前回申請した資料を修正し、修正した箇所を「研究計画書等修正審査依頼書(委員会書式)」に記載してください。(【記載例】研究計画書等修正審査依頼書)
申請システム上の資料を差し替え「研究計画書等修正審査依頼書」(必要な場合は新旧対比表)を添付し、再度申請ボタンを押してください。(※ 申請システム修正手順)
東北大学 認定臨床研究審査委員会申請システム(臨床研究法対応版)
(2)『不承認』の審査結果通知
「申請された研究を承認できるような条件を特定することができない程の懸案事項がある、または要確認事項や問題点等の量や数が相当なものである」と委員会が判断した場合は、『不承認』の審査結果が発行されます。委員会の指摘に基づき再検討してください。
研究計画書を修正して再度委員会に提出する際は、改めて研究の新規申請を行っていただくこととなります。
