疾病等報告とは
研究責任医師は、疾病等(臨床研究の実施に起因するものと疑われる疾病、障害若しくは死亡⼜は感染症(臨床検査値の異常や諸症状を含む))のうち重篤な疾病等の発生を知ったときは、実施医療機関の管理者に報告した上で、認定臨床研究審査委員会に報告し、継続の可否についての審査を受けなければならないこととなっています。
また、重篤な疾病等の一部については、厚生労働大臣への報告が必要です。
臨床研究法における疾病等の取り扱いについては、以下リンク先をご覧ください。
【参考】
臨床研究法における安全性情報の取扱い(東北大学病院臨床研究推進センター)
また、疾病等報告の報告先、報告期限については下表をご覧ください。
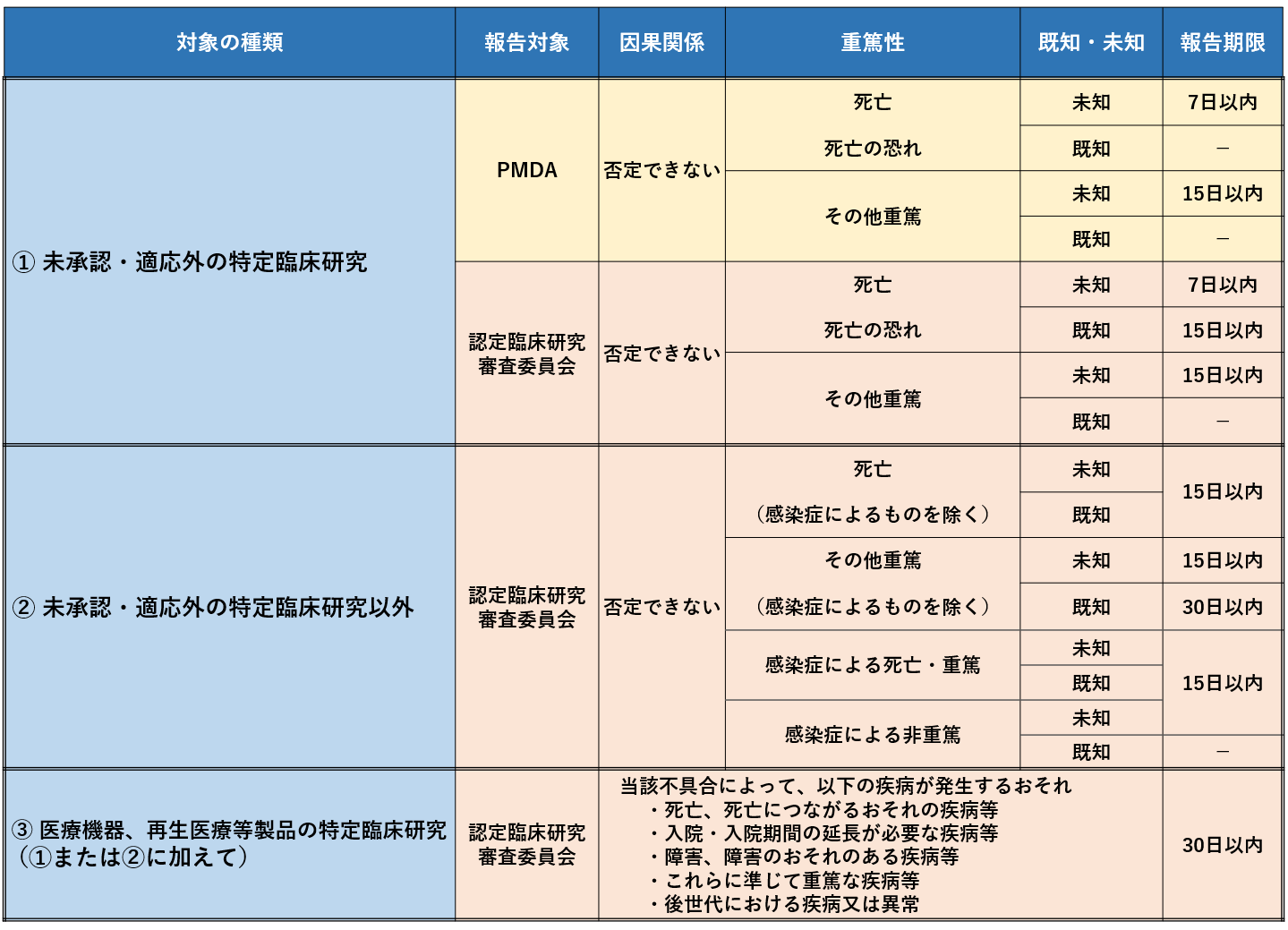
重篤な疾病等報告の手続き
(1)重篤な疾病等報告の審査
- 重篤な疾病等報告の審査を希望する場合は、倫理審査申請システムから申請を行ってください。
東北大学 認定臨床研究審査委員会申請システム(臨床研究法対応版)
委員会の開催日及び〆切については「委員会日程」 のページをご確認ください。
- ご不明な点は、お問い合わせフォーム よりお問い合わせください。
(2)重篤な疾病等報告のフロー
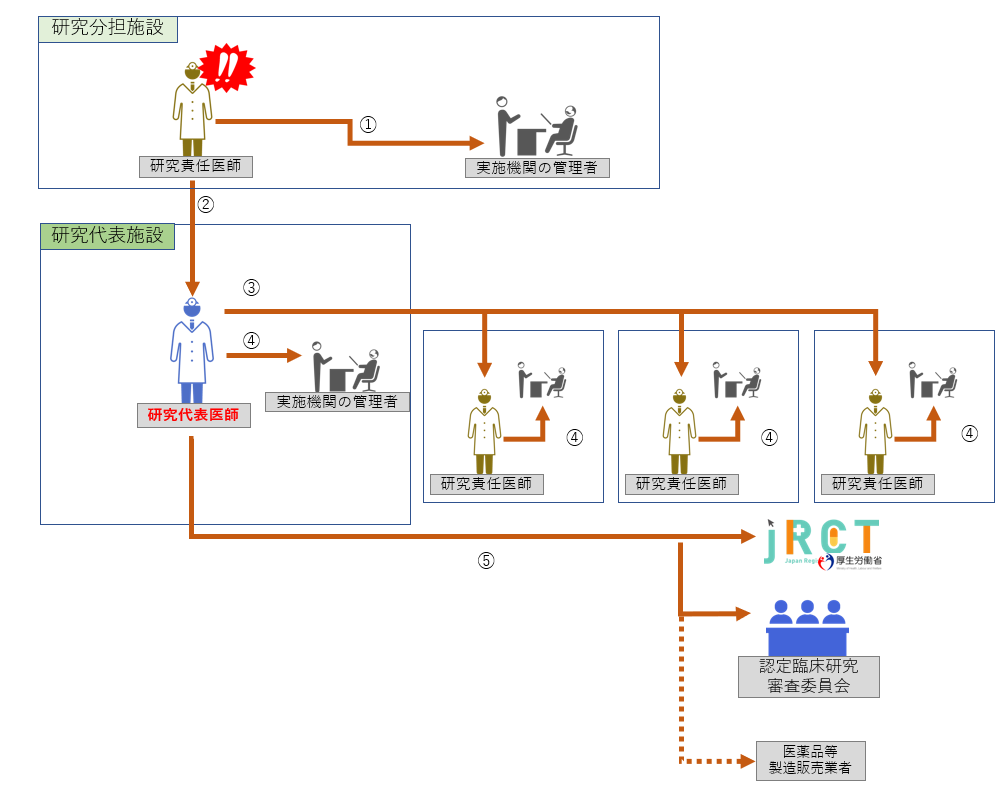
重篤な疾病等報告の際の手順は以下をご参照ください。 【フロー図】
Step1:認定臨床研究審査委員会の審査まで
|
① ≪発生機関≫ ② 研究代表医師への報告 ③ 他の研究責任医師への情報共有 ④ ≪非発生機関≫ ⑤ (必要な場合)jRCTへの届出 |
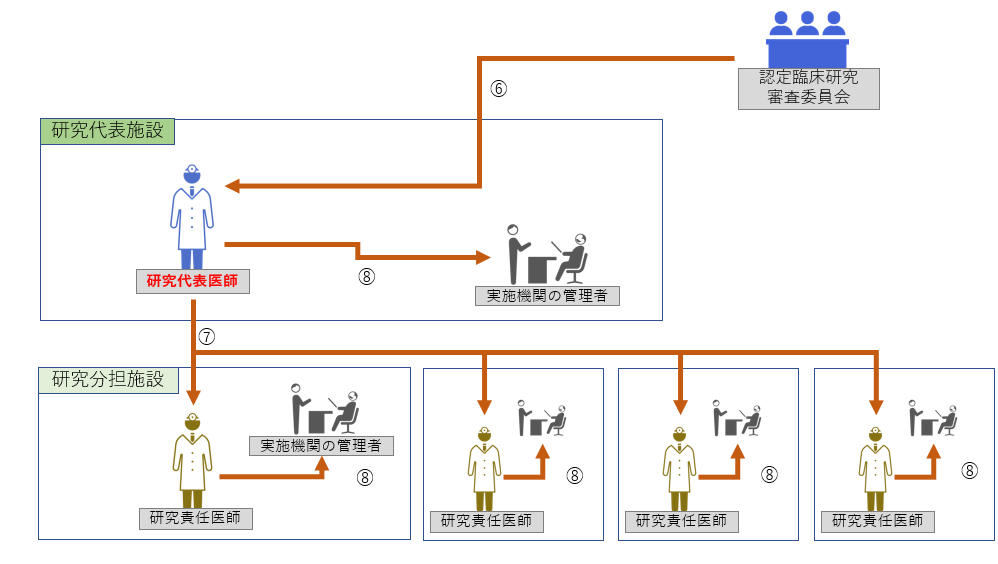
Step2:認定臨床研究審査委員会の審査後
|
⑥ 審査結果の受領 ⑦ 研究責任医師への情報共有 ⑧ ≪全機関≫ 実施医療機関の長への報告 |
(3)提出書類
重大な疾病等報告の審査の際の提出書類は以下のとおりです。
| No. | 書式名 | 備考 |
|---|---|---|
| ① | 疾病等報告書(統一書式8または9、10) (各種書式) | |
| ② | 疾病等報告書詳細報告用(統一書式) (各種書式) |
なお、厚生労働大臣への報告は、jRCTから「別紙様式2-1 疾病等報告書(医薬品)」または「別紙様式2-2 疾病等報告書(医療機器)」を作成し行います。
